
信息之窗
同济大学医学院癌症中心王平课题组揭示肿瘤干细胞调控新机制
来源:同济医学院关工委编辑录入:OY 2019/1/2 23:52:17 435
来源:同济新闻网 医学院 2019-01-02
肿瘤干细胞是导致肿瘤产生耐药性、潜伏及转移的关键因素,因此靶向肿瘤干细胞是治疗癌症的有效策略。转录因子NANOG(源于 Tir Nan Og 凯尔特语,意即永恒青春之地)对维持肿瘤细胞的干性至关重要,可作为多种癌症恶性程度和预后不良的标志。因此,阐明NANOG的表达调控机制有助于找到靶向肿瘤干细胞的有效药物靶点。NANOG是一个“短命蛋白”,半衰期很短,降解合成周转迅速,蛋白稳定性是调控其在肿瘤细胞中蛋白量的关键因素。
NANOG富含丝氨酸和苏氨酸,其多个位点可发生磷酸化修饰,从而调节其蛋白稳定性。在胚胎干细胞中NANOG的Ser52、Ser65、Ser71和Thr287可以发生磷酸化修饰,并促进其与蛋白异构酶Pin1的结合,阻碍NANOG的泛素化降解,增强NANOG的蛋白质稳定性。另外有研究发现在胚胎干细胞中ERK1能够磷酸化NANOG,招募FBXW8,促进NANOG的蛋白酶体降解,2016年王平课题组发现在胚胎干细胞中去泛素化酶USP21可去泛素化并稳定NANOG的蛋白水平,但是在肿瘤细胞中NANOG的泛素化调控机制尚不十分清楚。
同济大学王平教授长期致力于研究泛素化修饰与肿瘤微环境调控。12月27日最新一期Developmental Cell 杂志在线发表了王平教授团队题为AMPK promotes SPOP-mediated NANOG degradation to regulate prostate cancer cell stemness 的研究论文,从蛋白质翻译后修饰的角度阐明了肿瘤干细胞调控的新机制及其在肿瘤发生发展中的作用。

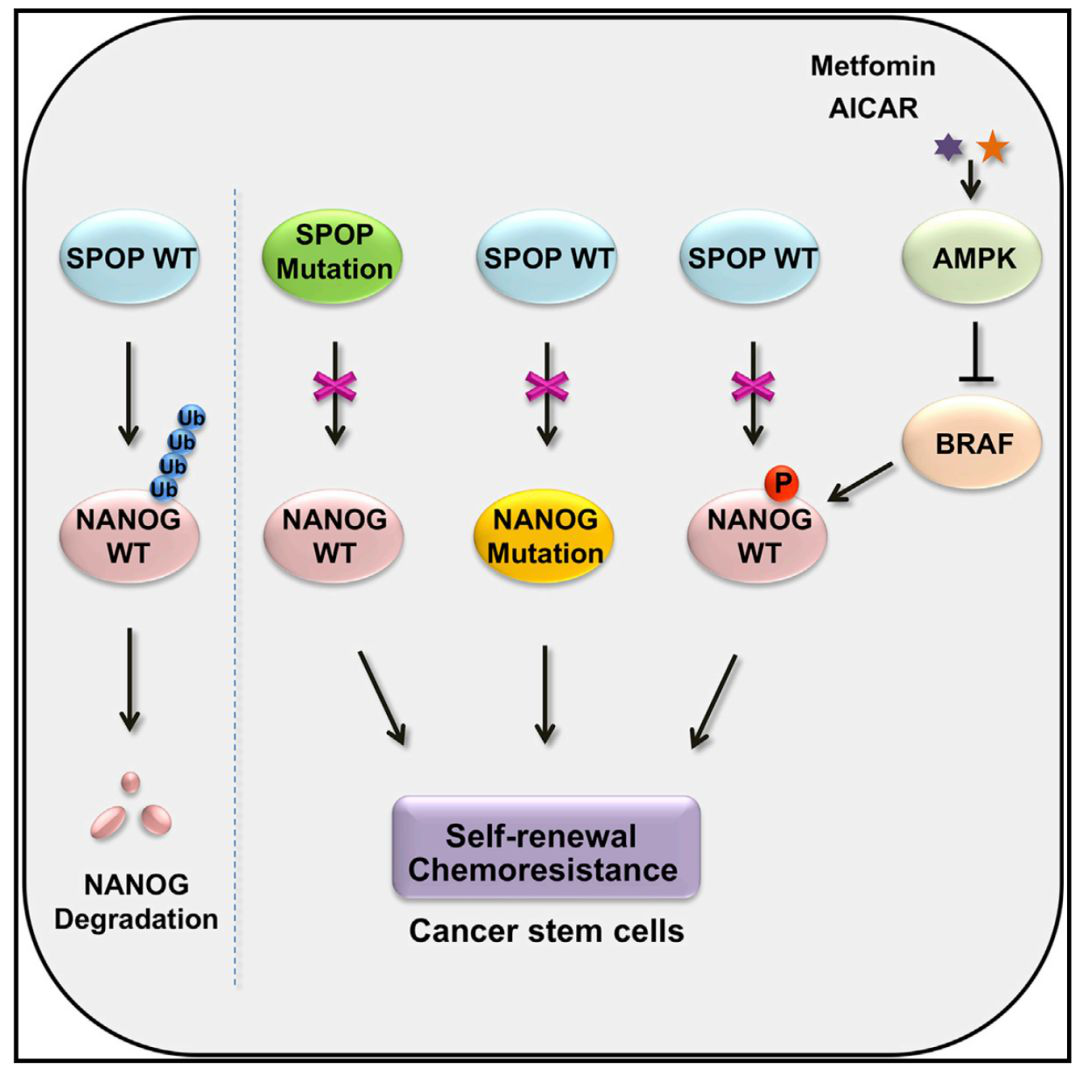
该工作发现干性因子NANOG可被Rbx1-Cul3-SPOP E3泛素连接酶复合体介导发生泛素化降解,进而抑制前列腺癌干细胞的自我更新和成瘤能力。SPOP是前列腺癌中发生突变频率最高的基因之一,突变率为10%-15%,其MATH结构域是突变热点,SPOP突变型的前列腺癌恶性程度更高,预后更差。进一步的实验结果表明SPOP通过MATH结构域结合NANOG,SPOP发生突变后丧失对底物的结合能力,而导致癌蛋白底物的累积,前列腺癌中最常见的SPOP突变体(Y87N/C、F102C和F133V/L)都丧失了结合并泛素化降解NANOG的能力。
SPOP通过识别并特异性结合底物蛋白序列中的降解决定子基序,进而促进底物蛋白的降解,进一步研究发现NANOG的N端序列含有一个保守的SPOP降解决定子(SBC)66PDSST70,缺失该基序后NANOG丧失与SPOP结合的能力,半衰期明显延长。另外,肿瘤相关的NANOG突变体S68Y与SPOP的结合能力明显减弱,从而不能被SPOP介导发生泛素化降解,并显著增强前列腺癌干细胞活性。
NANOG的SBC基序富含丝/苏氨酸,是潜在的磷酸化位点,质谱数据表明在生理状况下该基序可发生磷酸化修饰,NANOG-Ser68的磷酸化修饰可显著增强其蛋白质稳定性。进一步的研究发现AMPK-BRAF信号通路可抑制NANOG-Ser68的磷酸化,并增强NANOG与SPOP的结合能力,从而下调NANOG的蛋白水平,AMPK激活剂Metfomin和AICAR可抑制NANOG-Ser68的磷酸化,促进NANOG的泛素化降解,从而抑制肿瘤干细胞的活性,为靶向肿瘤干细胞治疗提供了潜在的靶点。
据悉,同济大学王平教授、复旦大学附属肿瘤医院叶定伟教授和上海第十人民医院葛欣副研究员为本文共同通讯作者。王平教授课题组王欣波、金佳丽和赵琳琳以及叶定伟教授课题组万方宁为本文共同第一作者。
值得关注的是,该论文与哈佛大学魏文毅教授的研究工作 SPOP promotes Nanog destruction to suppress stem cell traits and prostate cancer progression以“背靠背”形式同期发表在 Developmental Cell 上。

Copyright©2009-2019同济大学医学院关工委 版权所有