
信息之窗
生命科学与技术学院陈坤团队揭秘炎症“新帮凶”,成果发表于《先进科学》
来源:同济新闻网 2025年03月31日 编辑录入:O Y 2025/4/1 7:48:22 438
NLRP3炎症小体作为固有免疫应答的核心效应机制,其活化是机体应对病原体及组织损伤等危险信号的关键防线。然而,当NLRP3炎症小体异常激活时,会引发过度的炎症反应,成为驱动炎症性疾病(如痛风、类风湿关节炎、神经退行性疾病及代谢综合征等)发生发展的重要病理基础。因此,精准调控NLRP3炎症小体的活化与稳定性,对于开发针对NLRP3相关疾病的治疗策略具有重大科学意义和临床价值。然而,由于NLRP3炎症小体信号转导网络的复杂性和多层次性,现有干预手段难以实现对NLRP3活化的精准控制,亟待创新性的调控机制研究和药物开发。
近日,同济大学生命科学与技术学院陈坤教授团队在《先进科学》(Advanced Science)杂志上发表题为“UFMylation of NLRP3 Prevents Its Autophagic Degradation and Facilitates Inflammasome Activation”的研究论文,首次揭示了犹素化(UFMylation)这一新型蛋白质翻译后修饰在NLRP3炎症小体活化中的核心调控作用。该新型蛋白质翻译后可以防止NLRP3蛋白错误折叠导致的自噬降解,从而维持其稳定,促进炎症小体的活化。该研究不仅拓展了犹素化修饰的生物学功能范畴,更为炎症性疾病的治疗提供了全新的干预靶点。

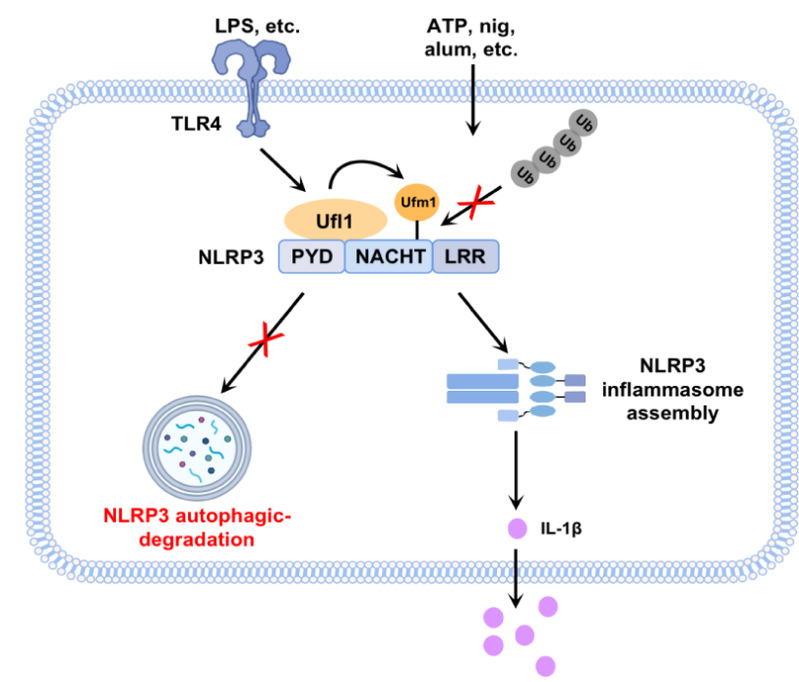
犹素化是一种类泛素化修饰,由UFM1(Ubiquitin-fold modifier 1)蛋白通过酶促级联反应共价结合到底物蛋白上,从而调控其活性、稳定性及亚细胞定位。该研究首次鉴定NLRP3蛋白为犹素化修饰的新底物,并阐明其修饰机制:犹素化E3连接酶Ufl1特异性识别并结合NLRP3蛋白,催化UFM1共价连接至NLRP3分子表面。该修饰抑制NLRP3发生K63连接的多聚泛素化修饰,从而阻断了NLRP3的自噬降解途径。犹素化修饰通过维持NLRP3蛋白的稳定性,为其寡聚化和炎症小体组装提供必要条件,最终促进IL-1β等促炎细胞因子的成熟与释放。
进一步,研究团队还通过腹腔注射LPS或明矾Alum构建了脓毒症小鼠模型和腹膜炎小鼠模型,明确犹素化修饰在NLRP3炎症小体活化中的生理病理意义。在以上模型中,与野生型小鼠相比,基因敲除Ufl1或Ufm1小鼠的肺组织中炎症细胞浸润显著减少,IL-1β、IL-18等炎症因子水平明显下降,表明NLRP3炎症小体活化受到有效抑制。
综上,犹素化修饰作为NLRP3炎症小体活化的新型调控机制,不仅增进了我们对炎症调控网络的理解,更为炎症性疾病的治疗开辟了新方向。通过抑制犹素化修饰,降低NLRP3蛋白稳定性,可能有效缓解痛风、类风湿关节炎、阿尔茨海默病等多种炎症性疾病的病理进程。该研究为相关炎症性疾病的防治提供潜在的靶点。
同济大学生命科学与技术学院博士后景炅婕、博士研究生杨帆和王科为论文共同第一作者。同济大学生命科学与技术学院陈坤教授和丁德强教授为论文共同通讯作者。该研究获得国家自然科学基金、上海市青年科技启明星计划、中国科协青年人才托举工程项目、免疫与炎症全国重点实验室创新开放课题重点项目、中央高校基本科研业务费、中国博士后科学基金等项目的资助。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202406786
Copyright©2009-2019同济大学医学院关工委 版权所有